
2025年6月10日,国家药品监督管理局药品审评中心(CDE)发布 《先进治疗药品的范围、归类和释义(征求意见稿)》,首次在法规层面明确了“先进治疗药品”(Advanced Therapy Medicinal Products,ATMPs)的定义和分类标准。这一监管框架的建立,标志着我国在细胞与基因治疗这一前沿领域迈入与国际先进水平“并跑”的新阶段。
一、CDE定义先进治疗药品新赛道
CDE将“先进治疗药品”定义为:符合药品管理规定,按药品路径研制生产,经体外操作生产并在人体内发挥预期功能的细胞治疗药品、基因治疗药品,以及采用其他基于微生物、细胞、基因或组织工程等创新技术生产的药品。这份征求意见稿首次系统构建了我国先进治疗药品的分类体系,将其划分为三大类别:
细胞治疗药品(CTMPs):包括非基因修饰细胞药品(如干细胞疗法)和体外基因修饰细胞药品(如CAR-T);
基因治疗药品(GTMPs):涵盖核酸类药品(如mRNA药物)、病毒载体类药品(如AAV载体疗法)、溶瘤微生物类药品以及基因编辑类药品;
其他创新类别:包括组织工程药品、新生抗原类治疗药品等前沿方向;
CDE在文件中特别强调,我国对“先进治疗药品”的分类体现了前瞻性和包容性,为新技术/新产品/新模式预留了接口或空间。
二、Cytiva赋能先进治疗药品全链条,闭环生产平台:实现“零暴露”生产
01
Sepax™ C-Pro全自动细胞处理系统:
封闭式完成细胞分离、洗涤、配液(适用CAR-T/TIL/NK细胞),避免人工操作污染;
配备多样化的程序,灵活使用,可满足不同的应用需求;
全程操作数据可追溯,确保合规的记录生产数据。

02
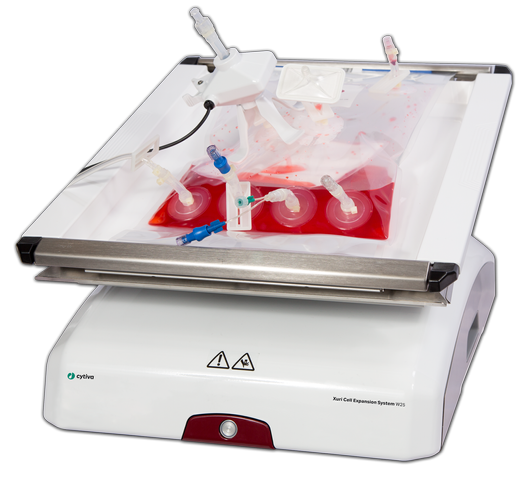
Xuri™ W25细胞扩增系统:
集成实时监测 + 一次性生物反应袋,确保扩增过程无菌可控;
密度达到 >10 x 106 个细胞/mL,体积最大可达 25 L,可在低强度环境中实现无损液体混合、培养基灌流和有效的氧气输送。
Cytiva已构建覆盖全产业链的技术解决方案,推出Sefia细胞治疗生产平台,助力细胞疗法的可及性提升。

# END #
©2022-2025 柏澳集 All Rights Reserved. 苏ICP备19039921号-2
建议您使用Chrome、Firefox、Edge、IE10及以上版本和360等主流浏览器浏览本网站。
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。
互联网药品信息服务资格证书编号:苏-经营性-2022-0029 、增值电信业务经营许可证:苏B2-20221250 、医疗器械生产(经营)许可证或备案凭证编号:苏泰食药监械经营备20207022号